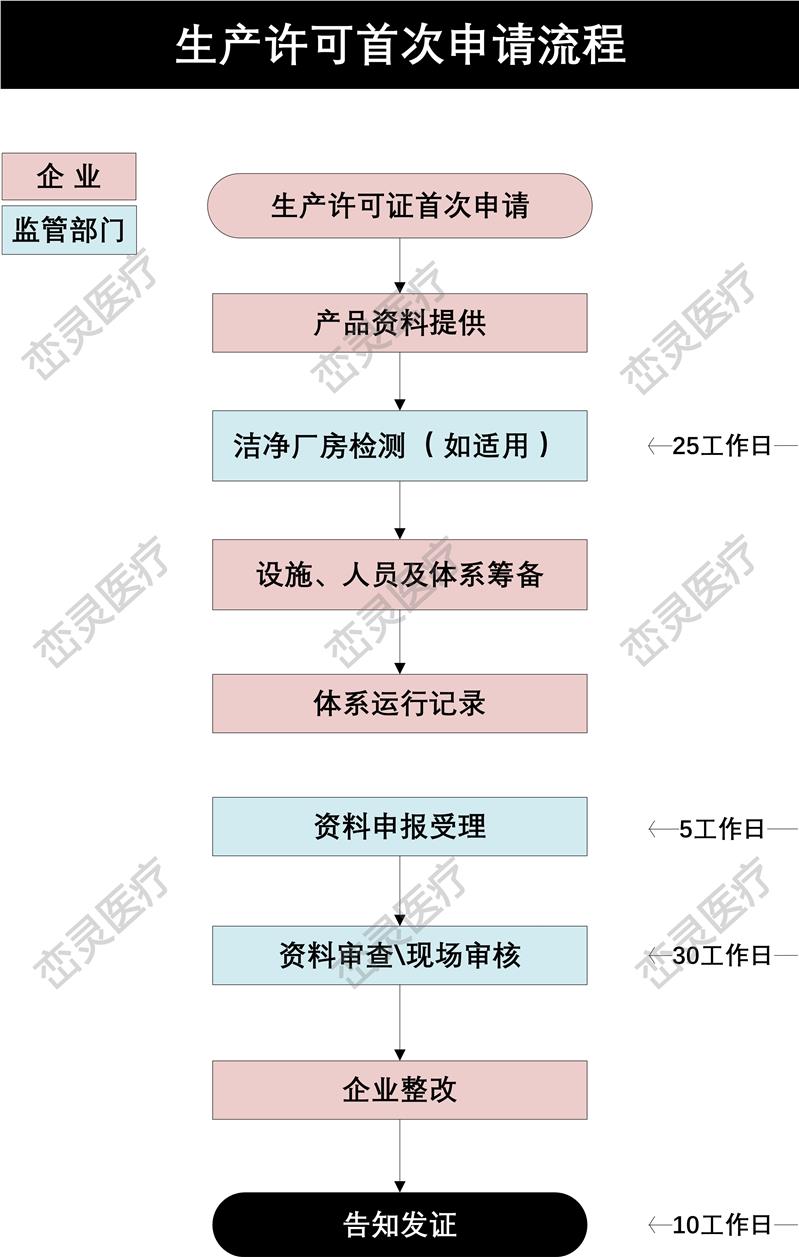
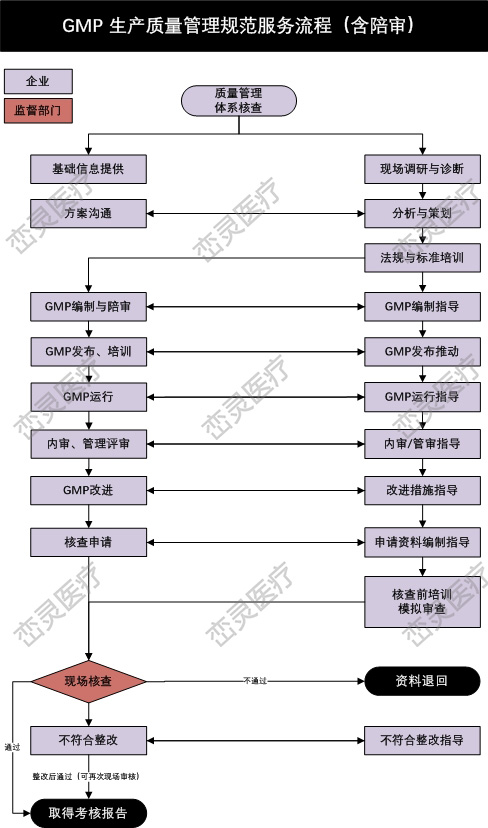
- 产品描述
ISO13485标准的全称是《器械 质量管理体系 用于法规的要求》(Medical device-Quality management system-requirements for regulatory)。
? 什么是支持?
– 管理者对质量管理体系和全员积极参与的支持。
? 提供充分的人力资源、基础设施和其他资源。
? 监视过程和结果。
? 确定和评估风险和机遇。
? 考虑现有内部资源的能力和局限,确定需要从外部获得的资源。
审核检查表
检查表的内容:
?审核的场所、部门、过程(活动)——到哪儿查?
?审核的对象——找谁查?
?审核的项目或问题——查什么?
?审核的方法(包括抽样计划)——如何查?
无菌(sterile medical device)
预期满足无菌要求的。
注意:应考虑各国法规和适用标准对无菌的要求。
例如:对终灭菌器械,欧盟协调标准EN 556-1要求:
For a terminally-sterilized medical device to be designated “STERILE”, the theoretical probability of there being a viable micro-organism present on/in the device shall be equal to or less than 1 * 10E-6.
器械质量管理体系咨询服务:
NMPA GMP、ISO 13485、FDA QSR820、MDSAP体系培训、建立及运行辅导。
峦灵是行业内的咨询公司,汇聚了来自法规、等各领域对法规有深刻理解的人士及*,致力为企业提供一站式、*、系统化的技术咨询服务, 帮助企业向**市场提供安全、有效和合规的产品, 迄今为止,我们已与众多公司开展合作, 协助他们将安全、有效、合规的产品迅速推向**市场。 我们的服务包括: 法规合规服务(CE认证、NMPA注册、FDA注册、**注册) 质量管理体系(ISO13485、NMPA GMP、MDSAP、FDA QSR820、质量体系日常维护服务); 测试服务(有源产品测试认证咨询、无源产品测试认证咨询、清洗消毒灭菌验证确认、定制化摸底测试服务) **注册(加拿大、澳大利亚、日本、巴西、韩国、俄罗斯、东南亚注等); 法规培训服务(企业定制培训、小班课培训)
欢迎来到上海峦灵医疗信息技术有限公司网站,我公司位于历史文化悠久,近代城市文化底蕴深厚,历史古迹众多,有“东方巴黎”美称的上海市。 具体地址是上海青浦公司街道地址,负责人是阮贞。
主要经营CE认证 FDA510K。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:CE认证,FDA注册,**注册等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们最大的收益、用户的信赖是我们最大的成果。
本页链接:http://www.cg160.cn/vgy-55109549.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
- 产品推荐
- 太原手绘墙体广告,运城墙体喷绘广告发布 大型壁画 杭州二类电商云仓怎么收费 诚信经营 壁虎云仓供应 吕梁刷墙广告,运城墙体喷绘广告发布 大型壁画 吕梁墙体写字广告,运城户外喷绘广告墙 集装箱彩绘 晋城油漆墙体广告,吕梁户外墙体喷绘 户外墙绘手绘墙 晋城户外墙体喷画,忻州喷绘广告墙 手绘墙画 2025-2031年中国苹果醋粉市场风险分析及销售态势研究报告 忻州路墙广告,晋中户外墙体喷绘 文明墙绘走廊 中国有机万寿菊油树脂行业风险评估及销售量分析报告2025-2031年 大同油漆墙体广告,长治喷绘写真广告制作 美丽乡村壁画 南京宣传片宣传片拍摄企业 信息推荐 南京天时数字科技供应 南京宣传片宣传片下载 服务为先 南京天时数字科技供应
关于上海峦灵医疗信息技术有限公司
商铺首页 |
更多产品 |
联系方式
峦灵是行业内的咨询公司,汇聚了来自法规、等各领域对法规有深刻理解的人士及*,致力为企业提供一站式、*、系统化的技术咨询服务, 帮助企业向**市场提供安全、有效和合规的产品, 迄今为止,我们已与众多公司开展合作, 协助他们将安全、有效、合规的产品迅速推向**市场。 我们的服务包括: 法规合规服务(CE认证、NMPA注..
- 我要给“云南ISO13485认证培训”留言
- 更多产品
相关分类