- 产品描述
单克隆抗体的优点:特异性高,只识别单一抗原表位,可减少非特异性结合;批间差异小,质量稳定;可大量生产。缺点:可能会因为识别的表位被破坏而无法结合抗原;价格相对较高。多克隆抗体的优点:能识别多个抗原表位,对抗原微小变化不敏感;制备相对容易,成本较低;通常具有较高的亲和力。缺点:特异性相对较低,易出现非特异性结合;批间差异较大,质量较难控制。在*组化实验中,需根据具体实验要求选择合适的抗体,若需要高特异性则单克隆抗体较合适,若对抗原识别要求不那么严格且考虑成本,多克隆抗体可能是一种选择。*组化的结果如何解读?中山多重*组化分析
*组化技术中的信号放大方法主要有以下几种。其一,酶促信号放大。利用酶催化底物产生大量有色或荧光产物,增强信号强度。例如过氧化物酶催化底物显色,碱性磷酸酶催化底物产生荧光。其二,生物素-亲和素系统。生物素与亲和素具有较高的亲和力,通过多级结合可放大信号。其三,聚合物法。使用带有多个结合位点的聚合物分子,同时结合多个抗体和标记物,实现信号放大。其四,纳米颗粒标记。纳米颗粒可以携带大量荧光分子或酶,提高检测灵敏度。其五,滚环扩增。在特定条件下,对核酸进行扩增,间接放大*组化信号。这些信号放大方法可以根据不同的实验需求和样本特点进行选择,以提高*组化技术的检测灵敏度和准确性。清远多重*组化原理通过*组化可检测特定蛋白的表达情况。
在*组化实验设计中,对照组的选择对于确保结果的特异性和有效性至关重要。首先,阳性对照组应选择已知含有目标抗原且能产生明确阳性反应的样本,这样可以验证实验体系的有效性,确保抗体能够正常识别抗原且染色过程正确。其次,阴性对照组可分为多种。空白对照即不加入一抗,只进行后续染色步骤,用于检测非特异性染色的情况。同型对照则使用与实验抗体同种型但不针对目标抗原的抗体,可排除抗体本身非特异性结合导致的假阳性。此外,还可以设置替代对照,用无关的抗原替代目标抗原,来验证抗体的特异性。通过合理设置这些对照组,在实验过程中可以对比实验组与对照组的染色结果,从而准确判断实验结果是由目标抗原特异性结合导致的,还是存在非特异性结合或实验体系的问题,确保实验结果的可靠性。
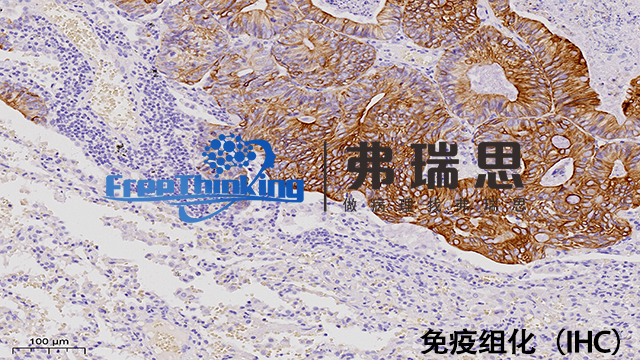
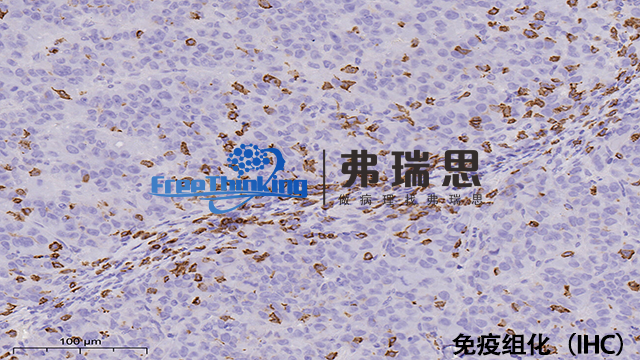
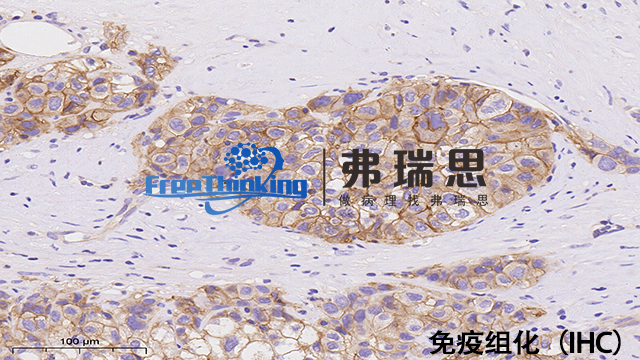
*组化即*组织化学技术。它是利用抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的研究。首先将组织样本进行处理,如固定、切片等。然后利用特定的抗体与组织中的目标抗原结合,再通过带有标记的二抗与一抗结合,使目标抗原被标记上可检测的物质,如荧光素或酶等。在显微镜下观察组织中抗原的分布和表达情况。*组化技术在病理诊断、生物学研究等领域有着广泛应用,可帮助判断疾病的类型、进展程度,研究细胞的功能和分子机制等。优化的抗原修复步骤能明显提升*组化染色的敏感性和特异性。
一、主要步骤原理1.抗原-抗体特异性结合。一抗与组织中的目标抗原结合,二抗与一抗特异性结合(通常二抗带有可检测标记)。2.显色反应。标记物与显色底物反应产生颜色变化,以显示抗原位置和表达程度。二、操作流程1.样本制备-石蜡切片脱蜡至水或冰冻切片固定。2.抗原修复-采用热修复或酶修复方法,暴露抗原决定簇。3.阻断内源性过氧化物酶-用3%过氧化氢溶液处理切片,减少非特异性染色。4.一抗孵育-滴加适当稀释的一抗,湿盒中孵育,使一抗与抗原结合。5.二抗孵育-一抗孵育后清洗,滴加二抗,再次孵育,二抗识别一抗。6.显色-根据标记物不同选择显色底物,如DAB显色,阳性部位出现颜色变化。7.复染与封片-苏木精复染细胞核后,脱水、透明、封片,便于观察。*组化的结果判读需要注意那些细节?淮安病理切片*组化扫描
*组化的价格是多少?中山多重*组化分析
要确保跨实验室*组化结果可比性,可采取以下措施。首先,建立统一的标准操作流程。包括样本固定、处理、染色步骤等都应明确规范,确保各实验室操作一致。其次,使用相同的试剂和抗体。选择质量稳定、经过验证的产品,并确保各实验室采购来源相同。再者,进行质量控制。各实验室定期进行内部质量控制,同时参与外部质量评估活动,对比结果并及时调整。然后,人员培训。对实验人员进行统一培训,确保他们对操作流程和结果判断有一致的理解。之后,数据共享与交流。各实验室间分享经验和问题,共同探讨解决方案,以不断提高*组化结果的可比性。中山多重*组化分析
南京弗瑞思生物科技有限公司是一家专注于组织病理学应用服务的企业,业务板块包括组织病理学整体方案、病理实验相关的试剂耗材开发以及开展病理研究相关的培训服务。多色荧光*组化及数字病理分析等相关病理应用是弗瑞思的重点技术。
欢迎来到南京弗瑞思生物科技有限公司网站,我公司位于文化底蕴厚重、历史遗存丰富的南京市。 具体地址是江苏南京江宁区公司街道地址,负责人是胡珺。
主要经营病理服务|试剂开发|病理培训|数字化病理图像分析。
单位注册资金:人民币 200 万元 - 300 万元。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:病理服务|试剂开发|病理培训|数字化病理图像分析等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们较大的收益、用户的信赖是我们较大的成果。
本页链接:http://www.cg160.cn/vgy-121763535.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
- 产品推荐
- 全qiu及中国老年人折叠电动代步车市场规划研究及前景深度分析报告2024-2030年 鄂州墙体广告广告用语触动人心 彩绘墙画农村墙体绘画 宝山广告设计类税收筹划咨询 上海吉择企业供应 全qiu及中国gou用镇定信息素产品市场战略预测及竞争趋势分析报告2024-2030年 湖北墙体广告扎实开展品牌下乡 文化墙彩绘桥梁彩绘 随州墙体广告字体浑厚有力 新农村建设墙体彩绘彩绘桥梁 全qiu及中国低碳交通流管理系统市场趋势洞察及投资**分析报告2024-2030年 台州油红O病理图像实验流程 南京弗瑞思生物科技供应 天门墙体广告广告用语触动人心 彩绘墙面绘画桥梁 黄石墙体广告抑扬顿挫百转千回 隧道彩绘艺术墙体彩绘 鄂州墙体广告**乡镇市场 新农村建设墙体彩绘手绘配电箱 南京电池材料游离锂检测 上海必通检测技术供应
- 我要给“中山多重*组化分析 南京弗瑞思生物科技供应”留言
- 更多产品