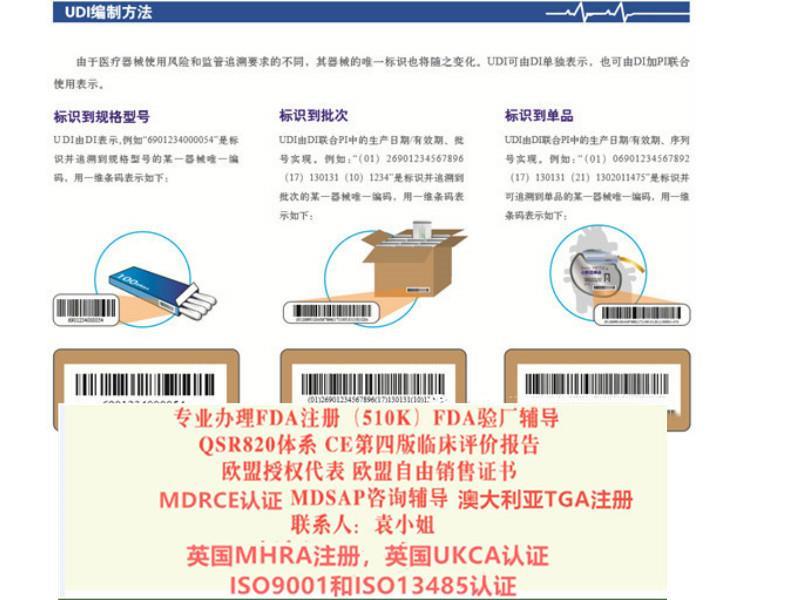
- 产品描述
级医用防护服、隔离衣、手术衣
级医用防护服、隔离衣、手术衣在MDR中属于普通Is类产品,需要公告机构的介入,获得公告机构颁发的CE证书才能出口到欧盟,具体流程如下:
① 选择具有MDR审核的公告机构,提交认证申请,签订认证合同;
② 建立符合欧盟法规和EN ISO13485:2016标准要求的体系;
③ 按照MDR附录II+附录III的要求编制CE技术文件;
④ 欧盟授权代表,签署《欧代协议》;
⑤ 公告机构对产品技术文件进行预审;
⑥ 完成公告机构现场审核及审核中不符合项的整改;
⑦ 公告机构颁发CE证书
⑧ 欧盟授权代表在欧洲进行产品注册。
510(k)是提交者必须比较一个或更多的类似合法上市的设备,使他们的设备和支持他们的实质性等同。
或者上市器械的指南为全新的,或与原来不同的情况下,要求递交新的,完整的510(k)文件。
我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE第四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
FDA QSR820
FDA QSR820 也叫 QSR (Quality System Regulation),是 21 CFR 820的一种简易叫法。
美国国会是法律的制定机构 . 其制定的《联邦食品药品和化妆品法案(Federal Food, Drug and Cosmetic Act) 》是美国关于器械管理的高法律性文件。
美国食品药品监督管理局 (FDA) 是负责器械管理的机构。其根据各相关法律授权而制定的各类法规性的文件编号为 21CFRxxxx(xxxx 为阿拉伯数字 )。其中 21CFR820 是 FDA 根据 <联邦食品 ,药品和化妆品法 > 第 501 、 502 、 510 、 513 、 514 、 515 、518 、 519 、 520 、 522 、 701 、 704、801 、 803 条款的授权而制定的规范器械企业质量体系要求的法规,即Quality System Regulation ,简称 QSR 或 QSR820。QSR 820 质量体系规范中描述了现行的生产管理规范的要求 (CGMP) 。本规范要求规定了所有器械成品在设计、制造、包装、标签、储存、安装和服务中使用的方法,设施和控制。这些要求是为了确保器械成品的安全和有效,并遵从美国食品药品和化妆品法。本规范提出了适用于器械成品制造商的基本要求,如果某制造商只进行本规范规定的一部分操作,而不进行其他操作,则该制造商仅需执行适用于他所进行操作的那些要求。有关1 类器械,设计控制仅按在 §820.30(a)(2) 中列出的要求进行。这个规范不适用于成品组件和零件的制造商,但鼓励这样的制造商使用规范的适当规定作为。
我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE第四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
谁要遵守 QSR820?
21QSR820.1 规定 , 所有在美国和波多黎各境内的 , 或者有产品出口到美国和波多黎各境内的器械企业必须按 QSR820 的要求建立质量体系。各企业可以根据实际情况,满足 QSR 中与自己活动相关的条款。QSR820 不适用于器械零件生产商,但 FDA 鼓励这类企业以 QSR820 中适用的条款为。 QSR820 不适用于人血和血制品生产商,这类企业应遵循 21CFR606 的规定。
SUNGO公司介绍 SUNGO GROUP: SUNGO TECHNICAL SERVICE INC美国公司; SUNGO Certification Company Limited英国公司 SUNGO Europe B.V.荷兰公司; SUNGO Cert GmbH德国公司; SUNGO Australia澳大利亚公司; 上海沙格企业管理咨询有限公司() 上海沙格企业管理咨询有限公司武汉分公司 上海沙格企业管理咨询有限公司广东分公司 SUNGO集团凭借全球网络和专业队伍为全球客户提供法规,在医疗器械行业尤为专长。 我们可以为您提供的自主服务项目主要有: 出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE第四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表、欧盟自由销售证书、防护服PPE指令Type5/6认证 出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC品FDA验厂辅导及整改 法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、监局自由销售证。 出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试 上海沙格企业管理咨询公司已经在国内近千家客户提供了相关服务,也受美国几家大型采购集团委托,对其在的供应商进行二方审核工作,我们的客户集中在无纺布行业企业、敷料耗材、病床、轮椅、体外诊断医疗器械行业、大型饲料机械设备企业、电子电器行业类别。公司一直秉承“专业辅导、增值服务、、本土价格”的方针,为客户提供优质的服务。 我们服务过的部分知名企业及上市公司有: 新华医疗、鱼跃医疗、威高集团、阳普医疗、艾迪尔医疗、驼人医疗、恒安集团、康德莱集团、阿蓓纳、上海联影、上海复旦医疗、微创骨科医疗、普罗医学、凯利泰、联医医疗、羚锐制、江西3L、正昌集团、杭州可靠、台钜集团、维达集团、青岛光电、科勒、暴龙眼镜等等
欢迎来到上海沙格企业管理咨询有限公司网站,我公司位于历史文化悠久,近代城市文化底蕴深厚,历史古迹众多,有“东方巴黎”美称的上海市。 具体地址是上海浦东陆家嘴公司街道地址,负责人是袁玲。
主要经营ISO13485认证。
本公司以科技为前导,质量为中心,全员为基础,依国际水准,创智博品牌。质量、信誉是公司生存和发展的基石;ISO9000质量体系为保证。选择我们的产品:咨询 管理咨询 ,是正确的决定!
本页链接:http://www.cg160.cn/vgy-108728555.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
- 产品推荐
- 北京大兴律师咨询 刑事案件辩护律师 济南软件安全风险评估 软件评测中心 广州腾创 华微检测 汕头药物制剂质量分析数据 金华光伏荷载检测 光伏安全排查 可靠性鉴定机构 律师事务 在线咨询 丰台区律师事务所 通辽屋面光伏安全检测 光伏安全排查 第三方 佛山大庆水质检测 免费咨询 房地产纠纷律师咨询 北京离婚房产争议律师 安康楼面光伏电站承重排查 光伏质量检测 全国范围 房屋律师咨询处 北京房屋交易法律咨询 外企厂房验厂安全鉴定 衡阳厂房结构 厂房结构检测 娄底竣工验收
- 相关文章
- 医用帽2017/745 2017/745 / EU的CE认证升级指南纸尿裤2017/745 MDR医疗器械分类规则瑞代 吸唾管瑞代要求 MDRCE辅导要求腕式血压计的英代认证要求 什么是英国授权代表医用绷带英国代表 什么情况下需要提供英代床边扶手fda认证510k 美国FDA510K认证是什么 如何申请杨克连接管UKREP认证怎么申请 英国授权代表是什么棉签美国FDA510K认证 美国FDA510K认证是什么 如何申请电动救护车担架2017/745 医疗器械MDR法规纱布块MDRCE证书怎么申请 mdrce认证 评估包含什么注射器的UKREP认证怎么申请 英国授权代表是什么口罩MDSAP认证 怎么做
关于上海沙格企业管理咨询有限公司
商铺首页 |
更多产品 |
联系方式
SUNGO公司介绍 SUNGO GROUP: SUNGO TECHNICAL SERVICE INC美国公司; SUNGO Certification Company Limited英国公司 SUNGO Europe B.V.荷兰公司; SUNGO Cert GmbH德国公司; SUNGO Australia澳大利亚公司; 上海沙格企业管理咨询有限公司() 上海沙格企业管理咨询有限公司武汉分公司 上海沙格企业管理咨询有限公司广东分..
- 我要给“化妆品的EU 2017/745认证周期 FDA510K 的周期多久”留言
- 更多产品