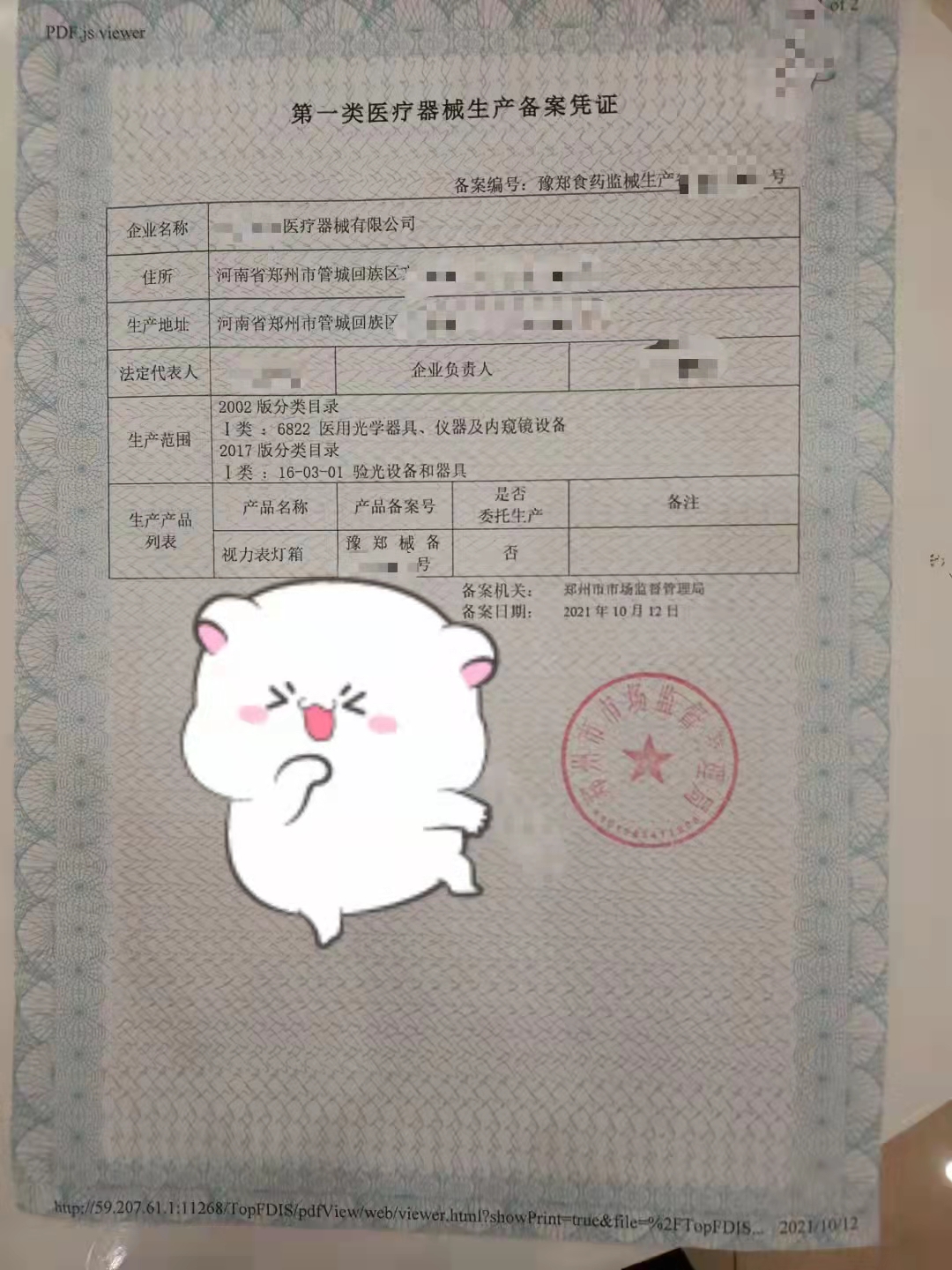
- 产品描述
一类医疗器械实行产品备案管理,医疗器械实行产品注册管理我公司从事公司注册,效率高,达到企业客户双赢,节约双方时间,减少不必要的资金,以真诚的心态,对待每一位客户,热情的服务,对待每一位客户的咨询。
一类医疗器械产品备案依据
1、《医疗器械监督管理条例》(*人民共和国令*680号,根据2017年5月4日《关于修改(医疗器械监督管理条例)的决定》修订)*八条,*十条;
2、《医疗器械注册管理办法》(国家食品药品监督管理总局令*4号,2014年10月1日起施行)*五条
3、国家食品药品监督管理总局2014年*26号公告《关于类医疗器械备案有关事项的公告》
4、国家食品药品监督管理总局2014年*8号通告《关于发布类医疗器械产品目录的通告》
5、国家食品药品监督管理总局2014年*9号通告《关于发布医疗器械产品技术要求编写原则的通告》
6、国家食品药品监督管理总局《关于印发体外诊断试剂分类子目录的通知》(械管〔2013〕242号)
7、国家食品药品监督管理总局办公厅《关于实施类医疗器械备案有关事项的通知》(办械管〔2014〕174号)
8、国家食品药品监督管理局办公室2013年*36号《关于进一步做好医疗器械产品分类界定工作的通知》
9、河南省局2015年*13号《关于做好类医疗器械产品备案工作的通知》
申请材料存在可以当场更正的错误的,应当允许有权更正人当场予以更正,由更正人在更正处签名或者盖章、更正日期;经确认申请材料齐全,符合法定形式的,应当决定予以受理。申请材料不齐全或者不符合法定形式的,应当当场告知申请人需要补正的全部内容。
国家药品监督管理局对同时符合下列情形的医疗器械按本程序实施审评审批:
申请人经过其技术创新活动,在中国依法拥有产品**技术发明权,或者依法通过受让**在中国发明权或其使用权;或者**技术发明的申请已由行政部门公开。
产品主要工作原理/作用机理为国内创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于**水平,并且具有显著的应用**。
申请人已完成产品的前期研究并具有基本定型产品,研究过实和受控,研究数据完可溯源。
一类医疗器械产品备案条件
1、申报备案的产品已经列入国家食品药品监督管理总局2014年*8号通告《关于发布类医疗器械产品目录的通告》附件中或国家食品药品监督管理总局《关于印发体外诊断试剂分类子目录的通知》(械管〔2013〕242号)附件中。
2、申报备案的产品无法界定的,应按照国家食品药品监督管理局办公室2013年*36号《关于进一步做好医疗器械产品分类界定工作的通知》对所申报的产品进行界定,属于类医疗器械产品食品经营许可管理办法。
河南艳阳雨速度快,效率高,服务一对一,欢迎合作
欢迎来到河南艳阳雨企业管理咨询有限公司网站,我公司位于中国商代早期和中期都城,商文明的发源地—郑州市。 具体地址是河南郑州金水区公司街道地址,联系人是杨经理。
主要经营河南艳阳雨企业管理咨询有限公司主要从事:二类医疗器械备案凭证、网络文化经营许可证、出版物经营许可证、互联网药品信息服务许可证等办理流程理业务,以真诚的心态,对待每一位客户,热情的服务,对待每一位客户的咨询。 。
单位注册资金:人民币 10 万元以下。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:河南艳阳雨企业管理咨询有限公司主要从事:二类医疗器械备案凭证、网络文化经营许可证、出版物经营许可证、互联网药品信息服务许可证等办理流程理业务,以真诚的心态,对待每一位客户,热情的服务,对待每一位客户的咨询。 等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们最大的收益、用户的信赖是我们最大的成果。
本页链接:http://www.cg160.cn/vgy-102697224.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
- 产品推荐
- 阿勒泰墙体广告 儿童口腔农村户外刷字广告 墙体写标语 中国碳纤维体育用品市场销售态势及投资风险评估报告2025-2031年 和田墙体广告 家纺墙体广告喷字 墙体喷绘广告 阿拉尔墙体广告 工程机械墙体汽车广告 手绘墙体广告 中国植物性不完全蛋白质市场未来需求分析及投资潜力研究报告2025-2031年 哈密墙体广告 甜品饮料外墙刷大字广告 手绘墙体广告 哈密墙体广告 保健药品手绘墙体字广告 墙体写标语 哈密墙体广告 智能锁墙体涂料广告 刷墙广告 博尔塔拉墙体广告 小家电墙体广告喷字 墙体彩绘广告 株洲两连体移动厕所定制厂家 喀什墙体广告 厨房电器喷墙体广告 户外广告 阿拉尔墙体广告 粮油调味墙上喷字广告 墙体彩绘广告
- 相关文章
- 郑州市二七区办理出版物经营许可证详解 河南艳阳雨企业管理咨询有限公司郑州市二七区办理注册公司代理记账周期 欢迎合作郑州市二七区办理注册公司代理记账周期 欢迎合作三门峡市营业性演出经营许可证办理机构 详情可以加微信管城区互联网药品信息服务许可证办理流程 详情可以加微信商丘办理增值电信ICPEDI基本流程 河南艳阳雨企业管理咨询有限公司郑州市高新区办理互联网药品信息服务许可证条件 河南艳阳雨企业管理咨询有限公司濮阳市办理房地产开发二级资料 详情可以加微信郑州市经济开发区办理医疗器械二类备案凭证全部资料 随时洽谈阜新医疗器械广告审查条件 欢迎合作新乡市ICPEDI许可证办理流程 详情可以加微信安阳市营业性演出经营许可证办理知识 详情可拨打
我公司从事公司注册,效率高,达到企业客户双赢,节约双方时间,减少不必要的资金,以真诚的心态,对待每一位客户,热情的服务,对待每一位客户的咨询。
- 我要给“经开区办理流程医疗器械一类产品备案凭证时间 河南艳阳雨企业管理咨询有限公司”留言
- 更多产品