- 产品描述
建立HACCP计划表深圳汉墨管理咨询有限公司是经广东省深圳市工商局批准并注册登记的具有法人资格的综合管理咨询公司。公司具有丰富的培训咨询人才资源并组建了各个管理模块的培训咨询团队,致力于通过培训或咨询帮助企业解决管理困惑,如:体系认证培训与咨询、社会责任验厂培训与咨询、质量管理培训与咨询、现场管理培训与咨询,精益生产项目辅导、企业管理诊断等。公司始终坚持“从实际出发,着眼于未来”的宗旨,为选择了我们公司的客户提供从未来需求考虑的符合企业实际的培训咨询方案。
食品安全小组根据以上步骤的输出,编制《HACCP计划表》,包括如下内容:
a)HACCP计划所要控制的危害;
b)已确定危害将被控制的关键控制点(CCPs);
c)针对每个危害,在每个关键控制点(CCP)上的关键限值;
d)对每个关键控制点(CCP)中每种危害的监视程序;
e)关键限值超出时应采取的措施;
f)负责执行每个监视程序的人员;
g)监视结果的记录。
HACCP计划的验证
a)目的:验证HACCP计划的要素得以实施且有效。
b)方法:检查监视记录,验证方案是否得到实施;运行HACCP计划,检查其控制的关键参数是否在预期范围内;检查设备、仪器、人员是否符合要求。
c)频率:运行或变更后重新运行时和不超过一年的时间间隔进行。进行。
d)职责:由HACCP小组负责。
e)记录:参加人员应填写验证签到表(会议签到表),编写操作性前提方案验证报告记录验证过程和结果。对验证不合格开立文件更改申请表或不合格处理单以对其进行纠正。
HACCP的执行
a)负责关键控制点监视系统的执行的人员应接受相关的培训并理解其重要性。
b)监视人员发现监视对象(关键参数)的单方向趋势逼近关键限值(或操作限值),在记录的同时,与其主管理沟通并采取《HACCP计划表》规定的措施,使用监视对象恢复正常。
c)监视人员或其主管应立即将监视记录和采取措施的情况报告评价监视结果的人员。评价监视结果人员审核监视记录,进行分析和评价,并视实际情况采取进行一步的行动。
d)当监视记录表明关键参数已经超出关键限值时,对该批次产品应作为潜在不安全产品,按《不合格品和潜在不安全品控制程序》处理。
e)当监视记录不能确定关键参数超出关键限值是偶然因素时,应按《纠正和预防措施控制程序》要求处理,查明原因并防止再次发生。
产品安全小组准备并提供:
1) 内、外部质量审核报告;
2) 不符合项报告表和纠正、预防措施的有关信息;
3) 对关键控制点的控制信息;
4) 产品质量的有关信息;
5) 加工线和布置状况的有关信息;
6) 程序文件和第三层次文件等;
7) 内外部信息交流结果;
8) 关键控制点验证结果。
质量计划的编制原则为:
a) 质量计划的内容要根据质量策划的内容和结果来确定;
b) 参照《质量手册》的有关内容,符合现行的食品质量安全方针、目标,并与食品质量安全管理体系文件内容协调一致;
c) 尽可能引用已有的质量文件中的相关内容,并根据的要求编制新的内容;
d) 根据实际情况,可编写总体质量计划,也可只编写有关的单项计划,如设计质量计划、采购质量计划、食品安全计划;也可针对某一特定的活动,如产品促销活动、用户服务周等;
e) 质量计划可以作为立的文件,也可以根据需要作为其他文件(如项目计划等)一部分。
信息交流(内/外部沟通):
1 信息交流的方式:管理例会、各类会议、培训、文件申请单、纠正/预防措施报告、相关报表、电话、板报宣传栏、声像资料、内部审核、电子邮件、内部网络、公告栏、意见箱、内部刊物等。
2 内部信息交流:
各部门对质量食品安全管理体系有任何的问题、建议、改善要求时,均可通过以上的适当沟通方式联络管理者代表或食品安全小组组长。
与质量食品安全直接相关的信息,部门及时联络品控部或食品安全小组,由其处理并填写《备忘录》,必要时须经管理者代表审阅后再作处理。对可能影响到质量食品安全的沟通联络信息须进行必要的记录。
必要时,与质量食品安全有关的重大信息在公司的管理例会讨论。
1.目的:
本程序规定了公司员工聘用、培训、考核的工作流程,明确相关责任、方法和要求,确保公司能获得生产、服务、食品安全管理等必需的人力资源,以确保公司所有员工能达到岗位技能要求,得到相关的培训及提高并胜任自己的工作。
2.范围:
本程序适用于公司所有员工的聘用、培训、考核和调整。
3.职责:
3.1 行政部负责员工的招聘、人事档案管理及新员工入职手续的办理。
3.2 各部门负责编制岗位说明和培训需求,参与员工聘用和考核工作。
3.3 行政部负责汇总各部门的培训需求,并编写《年度培训计划》;落实培训计划、保管培训记录,组织考核并记录;
3.4 总经理批准年度培训计划。
3.5 管理者代表负责制订员工考核评分标准,组织员工考核工作。
3.6 总经理负责批准岗位任职和员工考核评分标准,确定各岗位任职人员。
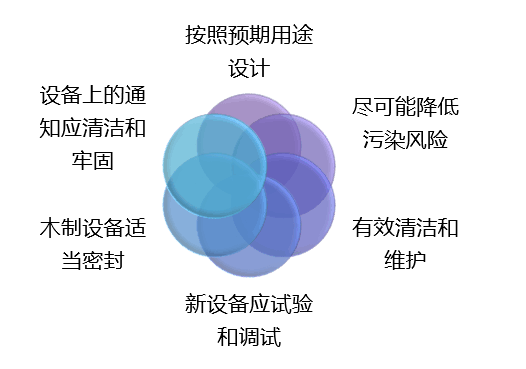
(a) 总则(1)每一个II类和III类器械的制造商和本部分列出的I类器械的制造商应建立和保持程序以控制器械的设计,确保规定的设计要求得到满足。
(2)下列器械应进行设计控制:
(i)由计算机软件进行驱动的器械
(b)设计和开发的策划:每一个制造商应建立和保持设计和开发活动的计划并规定实施职责。计划应识别和描述各不同部门或活动的接口,这些部门或活动提供设计和开发过程的输入。随设计和开发的进展,计划应得到评审、更新和批准。
(c)设计输入:每一个制造商应建立和保持程序以确保与器械相关的要求是适宜的并阐述用户和患者的要求。设计输入的要求应形成文件并由的人员评审和批准。应记录批准日期和批准人的签名。
(d)设计输出:每一个制造商应建立和保持程序以规定和记录设计输出,以便对设计输入要求的符合性进行充分的评价。设计输出程序应包含或引用接收准则,确保识别出那些对器械的正常运作十分必要的设计输出结果。设计输出在发布前应得到评审和批准。应记录批准日期和批准人的签名。
(e)设计评审:每一个制造商应建立和保持设计评审程序,以确保对设计结果的正式评审在设计开发的适宜阶段得到策划和实施。评审的参加者包括与所评审的设计和开发阶段有关的职能的代表,不直接负责所评审的设计和开发阶段的人员和所需的。在设计历史文档(DHF)中记录设计评审的识别、日期和完成评审的人员。
(f)设计验证:每一个制造商应建立和保持设计验证程序。设计验证应确保设计输出满足设计输入要求。在设计历史文档(DHF)中记录设计验证的识别、验证的方法、日期和验证的人员。
(g)设计确认:每一个制造商应建立和保持设计确认程序。设计确认活动应在规定的操作条件下完成。设计确认应确保器械符合规定的用户需求和预期的使用用途,应包括在真实或模拟使用条件下对产品单元的测试。适当时,设计确认应包括软件的确认和风险分析。在设计历史文档(DHF)中记录设计确认的识别、方法、日期和完成确认的人员。
(h)设计转换:每一个制造商应建立和保持程序以确保器械的设计能够正确的转化成生产规范。
(i)设计更改:每一个制造商应建立和保持设计更改的程序,程序应包括设计更改的识别、记录、确认,适当时更改实施前的验证、评审和批准。
(j) 设计历史文档(DHF):每一个制造商应建立和保持每一类型器械的设备历史记录。DHF应包括必要的记录,这些记录应能器械的设计是按照符合已批准的设计计划和本部分要求来完成的。
服务区域
服务广东省珠三角、粤东、粤西和粤北四个区域,其中珠三角:广州、深圳、佛山、东莞、中山、珠海、江门、肇庆、惠州;粤东:汕头、潮州、揭阳、汕尾;粤西:湛江、茂名、阳江;粤北:韶关、清远、云浮、梅州、河源。
汉墨提供以下认证及培训辅导咨询项目(包括但不限于):
1、认证与验厂(质量、食品安全、环境、安全等): ISO9001(ISO9000)质量管理体系认证、ISO22000食品安全管理体系认证、BRC食品安全全球标准认证、IFS、HACCP危害分析与关键控制点管理体系认证、FSSC22000食品安全体系认证、ISO14001环境管理体系认证、ISO45001职业健康与安全管理体系认证、IATF16949汽车质量管理体系认证、ISO50001能源管理体系认证、ISO13485、ISO22716、GMP良好操作规范认证、FSC森林COC产销监管链体系认证、GAP良好农业规范认证、BSCI社会责任验厂、SEDEX、WRAP、SA8000、体系内审员培训等。
2、管理培训:管理自我(以客户为中心、情绪管理、执行力、个人行为特征、自我认知),管理业务,管理他人(MTP中高层管理能力提升、目标与计划管理、以经营为导向的卓越绩效、团队管理、冲突管理、辅导下属)等。
3、管理咨询:组织架构梳理及人才战略、领导力测评与发展服务、培训管理体系搭建、企业文化梳理与落地等。
您有任何疑问,请随时与我们联系!
欢迎来到深圳汉墨管理咨询有限公司网站,我公司位于经济发达,交通发达,人口密集的中国经济中心城市—深圳。 具体地址是广东深圳龙岗区公司街道地址,负责人是林先生。
主要经营ISO9001认证。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:商务服务 认证服务 等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们最大的收益、用户的信赖是我们最大的成果。
本页链接:http://www.cg160.cn/vgy-102275587.html
以上信息由企业自行发布,该企业负责信息内容的完整性、真实性、准确性和合法性。阿德采购网对此不承担任何责任。 马上查看收录情况: 百度 360搜索 搜狗
关于深圳汉墨管理咨询有限公司
商铺首页 |
更多产品 |
联系方式
深圳汉墨管理咨询有限公司是经广东省深圳市工商局批准并注册登记的具有法人资格的综合管理咨询公司。公司具有丰富的培训咨询人才资源并组建了各个管理模块的培训咨询团队,致力于通过培训或咨询帮助企业解决管理困惑,如:体系认证培训与咨询、社会责任验厂培训与咨询、质量管理培训与咨询、现场管理培训与咨询,精益生产..
- 我要给“良好操作规范体系认证-哈尔滨GMP认证标准-资料协助 一站服务”留言
- 更多产品

佛山BRC认证食品安全体系内审员培训 内部审核员证书办理 正规证书 专业公司需要那些材料

揭阳BRC认证食品安全体系内审员培训证书 内部审核员证书办理 正规证书 专业公司需要那些材料

深圳ISO9001认证质量管理体系内审员培训流程 内部审核员证书办理 正规证书 专业公司需要那些材料

中山ISO14001认证环境管理体系内审员培训申请 内审员证书办理 耐心辅导 专业权威需要那些材料

FSSC22000认证食品安全体系内审员培训咨询 内审员证书办理 耐心辅导 专业权威需要那些材料

东莞ISO22000认证食品安全管理体系内审员培训流程 内审员证书办理 正规证书 专业公司需要那些材料

汕头ISO22000认证食品安全管理体系内审员培训机构 内部审核员证书办理 耐心培训 权威机构需要那些材料

内审员培训申请 内部审核员证书办理 耐心培训 权威机构需要那些材料

惠州GMP认证良好操作规范管理体系内审员培训费用 内审员证书办理 耐心辅导 专业权威需要那些材料

珠海内审员培训流程 内审员证书办理 耐心培训 权威机构需要那些材料

惠州ISO14001认证环境管理体系内审员培训报价 内部审核员证书办理 证书权威 办理高效需要那些材料

珠海HACCP认证食品安全体系内审员培训辅导 内审员证书办理 费用合理 专业高效需要那些材料
相关分类